Výběr ortogonálních stavebních bloků
Novabiochem® produktová řada má jednu z největších kolekcí ortogonálně a kvaziortogonálně chráněných trifunkčních aminokyselin. Tyto deriváty jsou užitečnými nástroji pro syntézu cyklických a rozvětvených peptidů a peptidů nesoucích modifikace postranních řetězců. Vlastnosti selektivně chráněných aminokyselin společnosti Novabiochem® jsou uvedeny v tabulce 1.
Diaminopropionová kyselina/butanová, deriváty ornitinu a lyzinu

Fmoc-Dpr(ivDde)-OH, Fmoc-Dab(ivDde)-OH, Fmoc-Orn(ivDde)-OH, Fmoc-Lys(ivDde)-OH, ivDde-Lys(Fmoc)-OH

Fmoc-Dpr(Mtt)-OH, Fmoc-Dab(Mtt)-OH, Fmoc-Orn(Mtt)-OH, Fmoc-Lys(Mtt)-OH

Fmoc-Lys(Mmt)-OH
Dde/ivDde
Od zavedení Dde1 a ivDde2 amino-ochranných skupin v roce 1993, resp. 1998, se strategie Fmoc/xDde stala standardním přístupem pro syntézu rozvětvených, cyklických peptidů a peptidů modifikovaných postranními řetězci pomocí Fmoc SPPS, přičemž použití těchto ochranných skupin je citováno ve více než 200 publikacích3.
Užitečnost této strategie vyplývá ze skutečnosti, že primární aminy chráněné Dde a ivDde jsou stabilní vůči 20% piperidinu a TFA, ale štěpí se 2% hydrazinem v DMF. Aminoskupiny chráněné těmito skupinami lze tedy selektivně demaskovat na pevné fázi, aniž by byly ovlivněny ochranné skupiny postranních řetězců jiných zbytků, což usnadňuje následnou modifikaci specifickou pro dané místo. Reakci lze navíc sledovat spektrofotometricky, protože produkt štěpení indazolu silně absorbuje při 290 nm (obrázek 1).
Obrázek 1. Odstranění ivDde
Příklady použití strategie Fmoc/Dde zahrnují: rozvětvené1 a di-epitopické peptidy4, cyklické peptidy5,6, molekuly TASP7./sup>, fluorescenčně značené peptidy8, multifunkční sondy9 a ubichinované peptidy10.
Výběr mezi Dde nebo ivDde závisí na aplikaci. Dde se odstraňuje snadněji než ivDde, ale je mnohem méně robustní. Bylo pozorováno, že Dde podléhá migraci během piperidinem zprostředkované deprotekce N-ε-Fmoc-Lys a N-koncových zbytků Dpr, což vede ke změně jeho polohy v rámci peptidového řetězce; částečná ztráta byla zaznamenána během syntézy dlouhých sekvencí11. Na druhé straně obtížnější skupina ivDde nepodléhá vyluhování nebo migraci postranních řetězců v žádné významné míře, s výjimkou zvláštního případu Dpr12, ale občas se může ukázat jako velmi obtížně odstranitelná, zejména pokud se nachází na C-konci peptidu nebo v agregované oblasti sekvence.
K dispozici jsou fmoc deriváty lysinu, ve kterých jsou α- a ε-amino skupiny chráněny pomocí Dde a ivDde: Fmoc-Lys(Dde)-OH, Dde-Lys(Fmoc)-OH, Fmoc-Lys(ivDde)-OH; a ivDde-Lys(Fmoc)-OH. Pro Dpr a Dab jsou k dispozici pouze deriváty chráněné postranním řetězcem ivDde:
Jelikož hydrazin může také odstranit skupiny Fmoc i skupiny Dde a ivDde, při přípravě cyklických peptidů nebo peptidů modifikovaných postranním řetězcem strategií Fmoc/Dde se sestavení peptidové páteře obvykle dokončí před deprotekcí skupin Dde/ivDde. Konec N peptidu by měl být chráněn pomocí Boc, čehož lze dosáhnout buď přímým začleněním N-koncového zbytku jako aminokyseliny chráněné Boc nebo acylací volné N-koncové aminoskupiny s Boc2O.
Odstranění Dde nebo ivDde se obvykle dosáhne ošetřením pryskyřice 2% hydrazinem v DMF, ačkoli v případech, kdy se odstranění ivDde ukázalo jako obtížné, byly použity roztoky až 10% hydrazinu. Proces lze sledovat spektrofotometricky při stejné vlnové délce, jaká se používá pro sledování odstranění Fmoc, protože produktem reakce skupiny Dde nebo ivDde s hydrazinem je chromoforický derivát indazolu (obrázek 1). Dde a ivDde jsou rovněž stabilní vůči běžným činidlům používaným pro štěpení Boc (TFA nebo 50% TFA v DCM) a vůči DBU v běžných koncentracích (přibližně 2%) používaných pro odstraňování Fmoc.
Pokud se skupina ivDde nachází v blízkosti C-konce peptidu nebo peptid agregoval, může být odstranění ivDde velmi pomalé a často neúplné. Problému lze předejít u peptidů obsahujících lysin modifikovaný postranním řetězcem tím, že se pro inkorporaci těchto zbytků použije ivDde-Lys(Fmoc)-OH místo Fmoc-Lys(ivDde)-OH. Použití prvního z těchto způsobů umožňuje provést modifikaci postranního řetězce lysinu během prodlužování řetězce. Po začlenění ivDde-Lys(Fmoc)-OH do peptidového řetězce může být skupina Fmoc na bočním řetězci odstraněna piperidinem, aminoskupina na bočním řetězci může reagovat s požadovanou molekulou funkcionalizovanou karboxylovou kyselinou před odstraněním ivDde hydrazinem a prodloužením řetězce obvyklým způsobem.
Úplná ortogonalita Dde s Fmoc byla prokázána, pokud byl použit hydroxylamin-hydrochlorid/imidazol (1.).3:1) v NMP namísto hydrazinu v DMF se použije k odstranění Dde13.
Metoda 1: Selektivní odstranění Dde/ivDde pomocí 2% hydrazinu v DMF
Šarže
- Umístěte peptidyl-resin do baňky a ošetřete 2% monohydrátem hydrazinu v DMF (25 ml/g). Baňku zazátkujte a nechte stát při rt po dobu 3 min.
- Pryskyřici přefiltrujte a ošetření hydrazinem ještě dvakrát zopakujte. Částečně chráněnou pryskyřici promyjte DMF.
Kontinuální průtok
- Proudí 2% monohydrát hydrazinu v DMF rychlostí 3 ml/min přes peptidylovou pryskyřici zabalenou v reakční koloně o průměru 1 cm. Deprotekci lze sledovat spektrofotometrickým sledováním absorbance eluantu kolony při 290 nm pomocí 0.Po dokončení reakce, které je indikováno návratem absorbance na původní hodnotu, propláchněte kolonu DMF.
Mtt
Skupinu Mtt lze z postranního řetězce lysinu nebo ornitinu odstranit pomocí 1% TFA v DCM14 nebo pomocí DCM/HFIP/TFE/TES (6.5:2:1:0,5) (metoda 2), což umožňuje selektivní odstranění v přítomnosti jiných ochranných skupin postranního řetězce, které vyžadují k odstranění až 95 % TFA. Při použití TFA se doporučuje přidat 1-5 % TIS nebo MeOH, aby se uhasily uvolněné tritylové kationty. Předběžné výsledky ukazují, že odstraňování MeOH zabraňuje ztrátě t-butylových skupin a předčasnému odštěpení z Rink Amide resins15 (metoda 2b).
Metoda 2: Odstranění Mtt z Lys na pevné fázi
a) DCM/HFIP/TFE/TES
- Dodává se DCM/HFIP/TFE/TES (6.5:2:1:0,5) (20 ml/g pryskyřice) k peptidylové pryskyřici.
- Směs nechte stát za mírného míchání 1 h.
- Odstraňte malý vzorek pryskyřice a promyjte ji DCM. Ke vzorku pryskyřice přidejte 1% TFA v DCM. Pokud se okamžitě vytvoří oranžové zbarvení, ponechte reakci další hodinu.
- Pokud je tritylový test negativní, promyjte pryskyřici DMF, 10% DIPEA v DMF, DMF a použijte v dalším kroku syntézy.
b) TFA/DCM/MeOH
- Přidejte TFA/DCM/MeOH (1:98:1) (15 mg/ml) k peptidylové pryskyřici. Po 1 min. vypusťte vodu.
- Přidejte k peptidylové pryskyřici čerstvý TFA/DCM/MeOH (1:98:1) (15 mg/ml) a nechte působit 16 h.
- Pryskyřice se promyje DMF, 10% DIPEA v DMF, DMF a použije se v dalším kroku syntézy.
Mmt
Skupina Mmt se odstraňuje podstatně snadněji než Mtt. Odštěpuje se rychle z postranního řetězce lysinu stejnými metodami, které byly popsány pro Mtt, ale lze ji odstranit i pomocí AcOH/TFE/DCM (1:2:7)16 nebo HOBt v DCM/TFE (metoda 3). Použití Fmoc-Lys(Mmt)-OH je ideální pro případy, kdy je odstranění Mtt problematické. Vzhledem k extrémní citlivosti skupiny Mmt na kyseliny se spojení Fmoc-Lys(Mmt)-OH nejlépe provádí pomocí PyBOP®/DIPEA nebo jiných bází zprostředkovaných spojovacích metod.
Metoda 3: Odstranění skupiny Mmt
- Přidejte 0.6 M HOBt v DCM/TFE (1:1) k pryskyřici nabobtnalé v DCM.
- Pozorně míchejte po dobu 1 h; roztok tmavne do červena.
- Rozpouštědlo se odstraní filtrací a kroky 1 & 2 se opakují.
- Pryskyřice se odstraní filtrací, promyje se DMF a ihned se použije v syntéze nebo se dále promyje DCM a poté MeOH, vysuší se a uchová se pro pozdější použití
Alloc
Alloc skupina je stabilní vůči působení piperidinu a TFA, ale lze ji snadno odstranit za mírných podmínek pomocí Pd(0) katalyzovaného allyl transferu17. Pro tento krok byla použita řada metod, ale pravděpodobně nejužitečnější je metoda Kates, et al. využívající Pd(Ph3P)4/CHCl3/HOAc/NMM18 (metoda 4). Skupina Alloc není kompatibilní s podmínkami použitými pro odstranění ivDde19. Předpokládá se, že přítomnost malého množství diazinu v hydrazinu způsobuje redukci dvojné vazby v allylové skupině. Tuto vedlejší reakci lze naštěstí snadno překonat přidáním allylalkoholu k hydrazinovému činidlu.
Metoda 4. Přídavek allylalkoholu k hydrazinovému činidlu:
Tato reakce je citlivá na vzduch a všechny manipulace by se měly provádět pod Ar.
- Peptidilovou pryskyřici navažte do zkumavky a vysušte při 40 °C ve vysokém vakuu. Zkumavku uzavřete gumovou přepážkou. Zkumavku propláchněte proudem Ar přiváděným jehlou zavedenou přes septum.
- Navažte Pd(PPh3)4 (3 ekv.) do suché zkumavky, přidejte CHCl3-AcOH-N-methylmorfolín (37:2:1) (15 ml/g pryskyřice), rozpusťte katalyzátor probubláváním roztoku proudem Ar a zkumavku uzavřete gumovou přepážkou.
- Tuto směs přeneste pomocí plynotěsné stříkačky proplachované Ar do zkumavky obsahující pryskyřici. Za občasného jemného míchání nechte 2 h stát.
- Přeneste pryskyřici do nálevky ze slinutého skla a postupně promyjte 0,5% DIPEA v DMF a diethyldithiokarbamátem sodným (0,5% hm.) v DMF, abyste odstranili katalyzátor.
Výše uvedený postup lze rovněž provést na jakémkoli automatickém syntetizátoru peptidů, který používá N2 míchání pro rozpouštění a přenos činidel. Pd(PPh3)4 katalyzátor by měl být navážen do kazety s aminokyselinami a rozpuštěn v CHCl3-AcOH-N-methylmorfolinu (37:2:1) za míchání Ar. Kazeta by měla být uzavřena a umístěna do autoloaderu přístroje jako obvykle. Přístroj by pak měl být naprogramován tak, aby přenesl obsah lahvičky do reakční nádoby nebo kolony bez přidání dalších činidel. Pokud má přístroj nějaké náhradní zásobníky rozpouštědel, lze je naplnit 0,5 % DIPEA v DMF a diethyldithiokarbamátem sodným (0,5 % hm.) v DMF, aby se umožnilo automatické promytí pryskyřice po allyldeprotekci.
Poznámka: Pokud se po odštěpení allylesteru odstraní N-koncová skupina Fmoc nebo pokud se má k cyklizaci použít karbodiimid, měla by se pryskyřice rovněž promýt HOBt/DMF.
Azido
Azidy lze za mírných podmínek redukovat thioly nebo fosfiny na odpovídající aminy. Proto jsou Fmoc-ochráněné aminokyseliny nesoucí azido funkční skupiny s postranním řetězcem užitečným nástrojem pro přípravu rozvětvených peptidů a peptidů modifikovaných postranním řetězcem. Azido skupina je stabilní vůči spojovacím podmínkám a vůči působení piperidinu. Je také stabilní vůči podmínkám štěpení TFA za předpokladu, že jsou z koktejlu vynechány thioly20. Redukce azidu na pevné fázi selektivně odmaskuje aminoskupinu na postranním řetězci, aniž by ovlivnila ostatní aminokyselinové zbytky21, 22.
Metoda 5: Redukce azidové skupiny na pevné fázi
- Pryskyřice se třikrát promyje dioxanem a dioxanem/vodou (4:1).
- Pryskyřici vysušte a přidejte 1 M Me3P v toluenu (6 eq.) do dioxanu/vody (4:1). Jemně míchejte po dobu 30 min.
- Odeberte malý vzorek pryskyřice a promyjte dioxanem a poté DCM. Přidejte 95% TFA a nechte štěpit po dobu 1,5 h. Analyzujte pomocí HPLC, abyste zkontrolovali úplnost redukce azido skupiny.
Deriváty Hse, Ser, Thr, Tyr a Cys

Fmoc-Cys(Mmt)-OH

Fmoc-Hse(Trt)-OH

Fmoc-Ser(Trt)-OH

Fmoc-Thr(Trt)-OH

Fmoc-Tyr(2-ClTrt)-OH
2-ClTrt/Trt/Mmt
2-ClTrt, Trt a Mmt skupiny lze odstranit z postranních řetězců Tyr, Hse/Ser/Thr.23 a Cys24 pouze pomocí 1% TFA v DCM, přičemž všechny ostatní ochranné skupiny zůstanou neporušené (metoda 6). To umožňuje selektivní deprotekci jediného zbytku pro následnou modifikaci postranních řetězců. U produktů s více zbytky Ser, Thr nebo Tyr je selektivita možná začleněním všech ostatních takových zbytků kromě zbytku, který má být modifikován, jako t-butyléter. Odstranění tritylové skupiny je rovnovážný proces, takže se musí provádět za použití silanů k vychytávání tritylových kationtů nebo v režimu kontinuálního toku k řízení rovnováhy. Pro Ser(Trt) popsali Coba, et al. 25 použití 20% kyseliny dichloroctové v DCM po dobu 10 min pro odstranění Trt. Tento postup může mít širší uplatnění i pro deprotekci dalších aminokyselin chráněných tritylem.
Nejčastějším využitím derivátů Ser/Thr/Tyr je příprava fosfopeptidů postsyntetickou metodou za použití fosforamiditového činidla.
Ve srovnávací studii byly při použití aminokyselin s tritylovou ochranou postranního řetězce získány čistší produkty než při použití standardních t-butylově chráněných aminokyselin26.
Metoda 6: Odstranění tritylových skupin na pevné fázi
Dávková metoda
- Předem rozpusťte suchou pryskyřici (1 g) s DCM v nálevce ze slinutého skla (typu s kohoutkem a zátkou). Odstraňte přebytečný DCM.
- Přidejte 94:1:5 DCM/TFA/TIS (10 ml), nálevku uzavřete a 2 min. protřepávejte. Odstraňte rozpouštědlo působením N2 tlaku.
- Třikrát opakujte krok 2.
- Pryskyřici promyjte DCM a vysušte ve vakuu.
Průtoková metoda
- Pryskyřice (1 g) se předem rozmíchá s DCM a zabalí do reakční kolony.
- Přes pryskyřici se čerpá 1% TFA v DCM (2 ml/min). Reakci lze sledovat měřením absorbance eluantu z kolony pomocí průtokové cely 0,1 mm při vlnové délce 460 nma.
- Po ukončení reakce, jak je indikováno návratem absorbance na základní hodnotu, propláchněte kolonu DCM.
aPokud peptid obsahuje jiné ochranné skupiny na bázi tritylu, hladina se nevrátí na výchozí hodnotu v důsledku pomalého vyplavování skupin Trt].
tButhio/STmp
Vložení Cys(tButhio)27 nebo Cys(STmp)28 zbytků do sekvence umožňují selektivní deprotekci thiolové skupiny na pevné fázi, což umožňuje buď modifikaci zbytků Cys, nebo tvorbu disulfidového můstku na rezinu.
T-butylthio skupina je stabilní vůči TFA za předpokladu, že se thioly nepoužívají jako odlučovače při štěpné reakci. Odstraňuje se redukcí buď thioly, nebo trialkylfosfiny29, 30. Nedávno Góngora-Benítez a spol.31 prokázali účinnost 20% β-merkaptoethanolu, 0.1 M NMM v DMF pro odstranění tbutylthia na pevné fázi, kde samotný β-merkaptoethanol nebo fosfiny byly neúspěšné.
V praxi se však často ukazuje, že je velmi obtížné odstranit tButhio skupinu na pevném nosiči. Z tohoto důvodu Albericio nedávno zavedl skupinu STmp28. Zdá se, že skupina STmp se velmi snadno odstraňuje mírnou thiolýzou, neboť Albericio uvedl odstranění čtyř skupin STmp na pevné fázi pouze třemi pětiminutovými ošetřeními 0,1 M N-methylmorfolínem (NMM) v DMF obsahujícím 5 % merkaptoethanolu (metoda 7).
Metoda 7: Odstranění STmp na pryskyřici pomocí thiolů
- Ošetření peptidylové pryskyřice 5% β-merkaptoethanolem, 0.1 NMM v DMF po dobu 5 min při rt.
- Pryskyřici promyjte DMF a ošetření thioly opakujte ještě dvakrát.
Deriváty Asp a Glu
Orthogonálně a kvaziorthogonálně chráněné deriváty Asp a Glu mají četné využití v syntéze peptidů a kombinatoriální chemii. Estery α jsou zvláště užitečné pro přípravu cyklických peptidů head-to-tail cyklizací na pryskyřici, zatímco selektivně chráněné β- a γ-- estery Asp a Glu lze využít při syntéze glykopeptidů a peptidů s postranním řetězcem nebo s laktamovým můstkem18, 31-36
Allyl

Fmoc-Asp/Glu-OAll/Fmoc-Asp/Glu(OAll)-OH
Allylové estery jsou stabilní při ošetření piperidinem a TFA, ale lze je snadno odstranit za mírných podmínek pomocí Pd(0) katalyzovaného allylového transferu18, jak bylo dříve popsáno pro alokovou skupinu (metoda 4).
Alylová skupina není kompatibilní s podmínkami použitými pro odstranění ivDde19. Předpokládá se, že přítomnost malého množství diazinu v hydrazinu způsobuje redukci dvojné vazby v allylové skupině. Tuto vedlejší reakci lze naštěstí snadno překonat přidáním allylalkoholu k hydrazinovému činidlu.
Dmab

Fmoc-Asp-ODmab, Fmoc-Glu-ODmab

Fmoc-Asp(ODmab)-OH, Fmoc-Glu(ODmab)-OH
Estery Dmab byly vyvinuty ve spolupráci Prof. B. W. Bycrofta a Dr. W. Chana z Nottinghamské univerzity a společnosti Novabiochem®, aby poskytly doplněk k aminochraně Dde. Konstrukce blokující skupiny Dmab je založena na principu safety-catch a známé náchylnosti p-aminobenzylových esterů k 1,6-eliminaci 37,38. Bezpečnostní pojistku zajišťuje ivDde skupina, která chrání aminofunkci nestabilního p-aminobenzylesteru během syntézy.
Ochrana
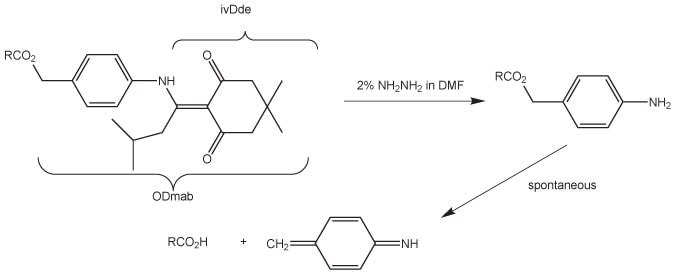
Ochrana Dmab je kvaziortogonální ke strategii Fmoc/tBu, protože estery Dmab jsou stabilní vůči 20% piperidinu v DMF a vůči TFA, ale jsou kvantitativně štěpeny 2% hydrazinem v DMF během několika minut. Odstranění Dmab zahrnuje dvoustupňový proces: ošetření hydrazinem nejprve odstraní N-ivDde skupinu; poté následuje rozpad vzniklého p-aminobenzylesteru se současným uvolněním karboxylové kyseliny (obrázek 2).
Deprotekční reakce může probíhat buď dávkovým, nebo kontinuálním průtokovým způsobem. V druhém případě lze reakci sledovat spektrofotometricky při 290 nm sledováním uvolňování vedlejšího produktu indazolu. Příležitostně bylo pozorováno pomalé odštěpení aminobenzylové části39-42 a zdá se, že je velmi závislé na sekvenci. V těchto případech bylo zjištěno, že promývání nosiče 20% DIPEA v DMF/vodě (90:10)39 nebo 5 mM hydroxidu sodného v methanolu42 je účinné. Protože hydrazin odstraní Fmoc, musí být sestavení peptidové páteře dokončeno před deprotekcí postranního řetězce Dmab. N-konec peptidu by měl být chráněn Boc. Toho lze dosáhnout buď přímým začleněním N-koncového zbytku jako aminokyseliny chráněné Boc, nebo acylací volné N-koncové aminoskupiny pomocí Boc2O.
Fmoc-Asp-ODmab byl použit k přípravě cyklického analogu pyrhokoricinu43, 29-merového cyklického peptidu s hlavou k ocasu44 a peptidu chlorofusinu45.

Obrázek 2. Odstranění Dmab
2-PhiPr

Fmoc-Glu(O-2-PhiPr)-OH

Fmoc-Asp(O-2-PhiPr)-OH
2-fenylisopropylová skupina (2-PhiPr)46 může být odstraněna z postranního řetězce Asp a Glu pomocí 1% TFA podle protokolu uvedeného v metodě 6. Použití této ochranné skupiny v kombinaci s Mtt na Lys nebo Orn poskytuje vynikající strategii pro syntézu laktamových peptidových můstků s postranním řetězcem. Na rozdíl od Dmab a All poskytuje skupina 2-PhiPr významnou ochranu proti tvorbě aspartimidu, což činí z Fmoc-Asp(O-2-PhiPr) derivát volby pro syntézu cyklických peptidů, které jsou náchylné k této vedlejší reakci.
Související produkty
Odkazy
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?