<제약 분야의 마이코플라즈마 검사
마이코플라스마 오염은 생명과학 연구 및 제약 산업에서 많은 세포 배양 시스템에서 광범위하고 반복적으로 발생하는 문제입니다. 마이코플라스마는 탁도와 같은 일반적인 박테리아 오염 징후 없이 배양 배지에서 높은 역가까지 성장할 수 있습니다. 배양 세포에 미치는 영향으로는 신진대사 변화, 증식 둔화, 염색체 이상 등이 있습니다. 요컨대, <마이코플라스마> 오염은 영향을 받은 세포주의 데이터 유효성과 생명과학 연구 결과의 신뢰성을 떨어뜨립니다. 따라서 <마이코플라즈마> 검사 및 오염 없는 세포 배양 유지가 세포 기반 연구와 소비자 건강이 주요 관심사인 제품 제조의 기본이 됩니다.
추천 카테고리
제약 제조를 위한 고급 환경 모니터링 및 무균 프로세스 시뮬레이션 솔루션을 알아보세요. 클린룸, 격리기 및 RABS를 위한 전문 도구와 미디어를 통해 GMP 준수를 보장합니다.

바이오안전성 테스트 서비스
바이오안전성 테스트 서비스 를 통해 mAb와 세포 및 유전자 치료, 백신 재료를 조사하여 다운스트림 공정에서 치명적인 실패를 초래할 수 있는 불순물이나 예기치 않은 결과가 없는지 확인합니다: 마이코플라스마 테스트
마이코플라스마> 박테리아 정보
마이코플라스마는 0.2µm의 기공 크기를 가진 필터를 통과할 수 있는 가장 작은 박테리아 중 하나입니다. 이 미생물은 호기성 또는 혐기성 조건에서 성장합니다.
마이코플라즈마는 기생하거나 부생합니다. 예를 들어, 와 같은 몇몇 종은 병원성이며 사람에게 폐렴 및 기타 호흡기 질환을 일으킵니다.
마이코플라즈마 오염원
실험실과 제조 과정에서 <마이코플라즈마> 오염원은 통제하기가 매우 어렵습니다. 일부 종은 사람의 피부에서 발견되며 부실한 무균 관행을 통해 배양액에 유입될 수 있습니다. 또한 마이코플라즈마는 태아 소 혈청과 같은 오염된 보충제를 통해 유입되거나 가장 흔하게는 다른 오염된 세포 배양으로부터 전염되어 유입될 수 있습니다. 세포 배양에 마이코플라즈마가 포함되면 이 미생물은 배양 취급 시 발생하는 에어로졸과 미립자에 의해 실험실 내 다른 공간으로 빠르게 확산되어 오염될 수 있습니다. 제조 공간에서 마이코플라스마 오염을 성공적으로 제어하려면 무균 실험실 관행을 엄격하게 준수하는 것이 핵심이며, 배양에 대한 정기적인 검사를 적극 권장합니다.
제약 산업에서 <마이코플라즈마> 테스트가 필요한 이유
백신 생산에 진핵세포를 사용하는 바이오제약 시설은 세포 은행과 바이러스 종자 로트뿐만 아니라 대량 백신의 <마이코플라즈마> 오염 여부를 테스트해야 합니다. 이 박테리아 속의 종은 진핵세포를 감염시켜 성장과 신진대사를 방해합니다. 마이코플라즈마가 백신 생산을 방해하면 단백질 품질과 생산량에 영향을 미치고 최종 백신 제품을 투여받는 환자에게 부작용을 일으킬 수 있습니다.
마이코플라즈마에 의한 생물반응기 오염은 제조 공정 초기에 발견하지 않으면 시간, 재료 및 수익에 상당한 손실을 초래할 수 있습니다. 바이오의약품 생산 배치의 마이코플라즈마 오염은 엄격한 테스트 루틴 없이는 발견하기가 매우 어려운데, 이는 마이코플라즈마의 존재가 일반적으로 배양 배지의 pH 변화나 시각적 혼탁으로 이어지지 않기 때문입니다. 종합적인 <마이코플라즈마> 검사 방법에는 검출을 위한 배양 및 지표 세포 검사가 모두 포함됩니다. 분석에 두 가지 배지만 사용하는 경우, FREY와 FRIIS 배지를 함께 사용하는 것이 좋습니다.
마이코플라즈마
검사 방법바이오의약품, 백신, 세포 배양 및 바이러스 배양에 대한 마이코플라즈마 검사는 품질 관리 중 다양한 지점에서 실시하는 것이 중요합니다. 가장 일반적인 세 가지 테스트 방법은 다음과 같습니다:
- 마이코플라스마 배양: 마이코플라스마에 최적화된 세균 배양 배지에 테스트 샘플을 접종하는 방법
- DNA 염색법: 마이코플라스마 핵을 Hoechst 또는 DAPI로 카운터 염색하고 형광 현미경으로 이미지화
- 마이코플라스마가 샘플에 존재하는 경우 박테리아 DNA를 증폭하는 PCR(중합효소 연쇄 반응)
EP 2.6.7 및 USP 63에 따른 마이코플라즈마 검출 워크플로
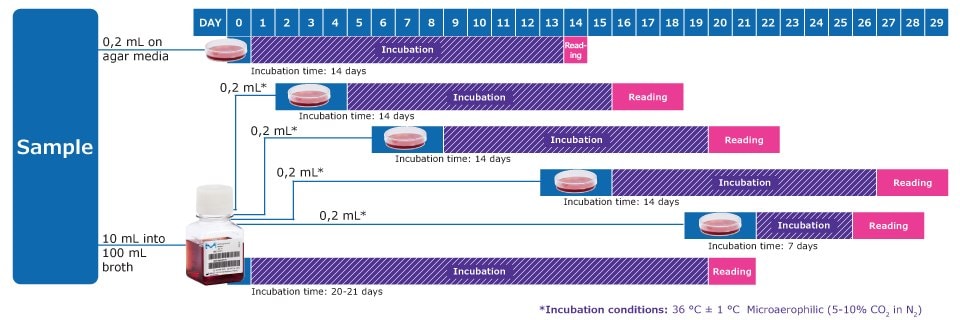
* On days after inoculation, subculture each liquid medium by inoculating 0,2 mL on at least 1 plate of each solid medium. Repeat the procedure between the 6th and 8th day, again between the 13th and 15th day and again between the 19th and 21st day of the test. Observe the liquid media every 2 or 3 days and if a color change occurs, subculture.
Note: In addition, one positive and one negative control per solid and liquid medium is required, with an incubation time of 14 days.
마이코플라즈마 검출을 위한 바로 사용 가능한 배지
유럽 약전 6.1(2.6.7.) 및 USP 35(63)에 따라 마이코플라즈마 검출에 필요한 바로 사용 가능한 액체 및 고체 배양 배지의 완전한 포트폴리오를 제공합니다. 비오메리으의 즉시 사용 가능한 <마이코플라즈마> 배양 배지는 추가 준비 단계 없이 로트별 분석 인증서를 통해 일정한 제품 품질과 완벽한 추적성을 보장합니다.
성분으로 인해 <마이코플라즈마> 배지는 일반적으로 미생물 품질 관리를 위한 대부분의 다른 배양 배지보다 훨씬 짧은 유통 기한을 가집니다. 바로 사용할 수 있는 프리스, 프레이, 헤이플릭 액체 및 고체 배지의 유통기한이 한천 플레이트의 경우 4개월, 브로스의 경우 6개월로 연장되었습니다. 보관 수명이 연장된 비오메리으의 모든 즉시 사용 가능한 배양 배지를 경험해 보시고 마이코플라즈마 검사를 더 쉽게 해보세요.
관련 기사
- Cell culture protocol for testing cell lines for mycoplasma contamination using indirect DNA staining using Hoechst 33342.
- 모두 보기 (1)
더 많은 기사 찾기
어떻게 도와드릴까요
문의사항이 있으시면 고객 지원 요청
을 제출하거나 고객 서비스 팀에 문의해 주세요:
이메일 [email protected]
또는 +1 (800) 244-1173
추가 지원
- Chromatogram Search
Use the Chromatogram Search to identify unknown compounds in your sample.
- 계산기 및 앱
웹 툴박스 - 분석 화학, 생명과학, 화학 합성 및 재료 과학을 위한 과학 연구 도구 및 리소스.
- Customer Support Request
씨그마 알드리치의 주문, 제품, 계정 및 웹사이트에 대해 궁금하신 부분을 확인할 수 있습니다
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
계속 읽으시려면 로그인하거나 계정을 생성하세요.
계정이 없으십니까?이 페이지는 고객의 편의를 위해 기계로 번역하였습니다. 정확한 번역을 제공하고자 노력하였으나 기계 번역은 완벽하지 않을 수 있습니다. 기계 번역된 내용에 만족하지 않으실 경우 영어 원문을 참고하시기 바랍니다.







