Macmillan Organokatalizatory imidazolidynonowe
Bezmetalowa kataliza asymetryczna
Opracowane przez profesora Davida MacMillana z Caltech, oparte na imidazolidynonie organokatalizatory zostały zaprojektowane jako ogólne katalizatory dla różnych asymetrycznych transformacji. Pierwsza wysoce enancjoselektywna organokatalityczna Reakcja Dielsa-Aldera z użyciem monochlorku (5S)-2,2,3-trimetylo-5-fenylometylo-4-imidazolidynonu została opisana przez MacMillana w jego pionierskiej pracy z 2000 roku (Schemat 1).1 Aktywowany jon iminowy, powstały w wyniku kondensacji imidazolidynonu i α,β-nienasyconego aldehydu, uległ reakcji z różnymi dienami dając [4+2]-cycloaddukty z doskonałą wydajnością i enancjoselektywnością.
![Enantioselective Organocatalytic Diels-Alder Reaction Using (5S)-2,2,3-Trimethyl-5-Phenylmethyl-4-Imidazolidinone Monohydrochloride Reakcja aktywowanego jonu iminowego, powstałego w wyniku kondensacji imidazolidynonu i α,β-nienasyconego aldehydu, z różnymi dienami z otrzymaniem [4+2]-cykloadduktów z doskonałą wydajnością i enancjoselektywnością.](/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/articles/chemistry-and-synthesis/reaction-design-and-optimization/enantioselective-organocatalytic/enantioselective-organocatalytic.jpg)
Schemat 1
Inne transformacje organokatalityczne, takie jak 1,3-dipolarne cykloaddycje,2 alkilacje Friedela-Craftsa,3 α-chlorowania,3 α-fluorowania,4 i wewnątrzcząsteczkowe reakcje Michaela5 zostały opisane przy użyciu katalizatorów organicznych imidazolidynonu MacMillana, wszystkie przebiegające z wysokim poziomem enancjoselektywności (Schemat 2).

Schemat 2
MacMillan znalazł zoptymalizowaną strukturę w (2S,5S)-(-)-2-tert-butylo-3-metylo-5-benzylo-4-imidazolidynonu do alkilowania indoli metodą Friedela-Craftsa (Schemat 3). 5,6
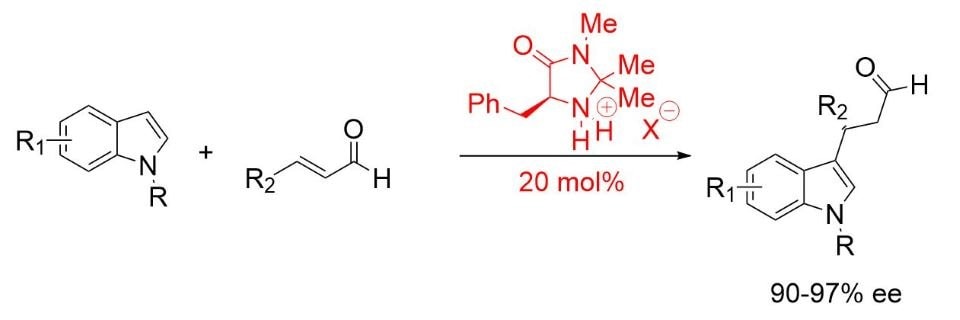
Schemat 3
Syntetyczna użyteczność tej koncepcji została później wykazana w całkowitej syntezie (-)-flustraminy B, biologicznie aktywnego alkaloidu zawierającego piroloindolinę (Schemat 4).7
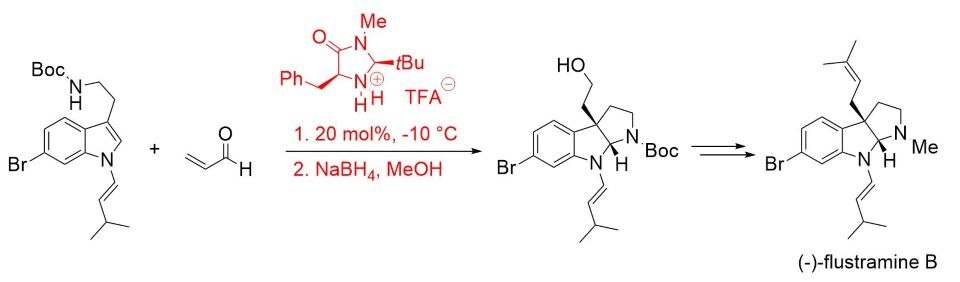
Schemat 4
Ostatnio, fotochemiczny protokół enancjoselektywnej α-alkilacji został opracowany i zastosowany do całkowitej syntezy (-)-enterolaktonu i (-)-enterodiolu. Reakcja przebiega w obecności światła widzialnego i przy braku fotokatalizatora poprzez aktywowany światłem kompleks przeniesienia ładunku. (Schemat 5).8
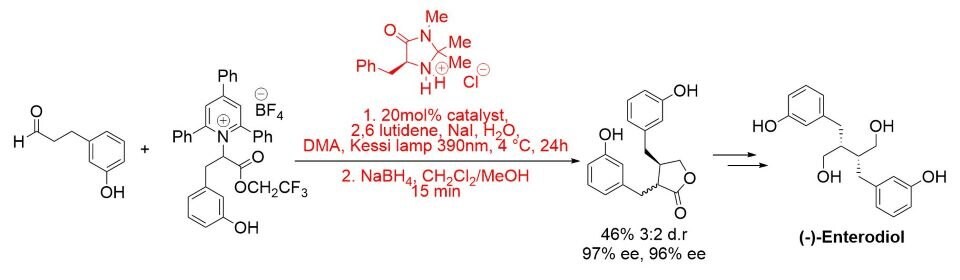
Schemat 5
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?Dla wygody naszych klientów ta strona została przetłumaczona maszynowo. Dołożyliśmy starań, aby zapewnić dokładne tłumaczenie maszynowe. Tłumaczenie maszynowe nie jest jednak doskonałe. Jeśli tłumaczenie maszynowe nie spełnia Twoich oczekiwań, przejdź do wersji w języku angielskim.