Protokoły hodowli indukowanych pluripotencjalnych komórek macierzystych
.Wprowadzenie
Indukowane pluripotencjalne komórki macierzyste (iPSC) mają zdolność do tworzenia zróżnicowanego potomstwa reprezentatywnego dla wszystkich trzech warstw zarodkowych organizmu: ektodermy, endodermy i mezodermy. Zdolność do ekspansji ludzkich komórek iPSC in vitro i poddania ich protokołom różnicowania specyficznym dla typu komórki ma kluczowe znaczenie dla generowania pochodzących od pacjentów modeli komórkowych "choroba w naczyniu" do podstawowych badań nad komórkami macierzystymi i zastosowań związanych z odkrywaniem leków.
Niniejszy przewodnik po protokole szczegółowo opisuje etapy rozmrażania, hodowli i kriokonserwacji ludzkich iPSC dostarczanych przez Europejski Bank Indukowanych Pluripotencjalnych Komórek Macierzystych (EBiSC). Linie ludzkich indukowanych pluripotencjalnych komórek macierzystych (iPSC) różnią się od wszystkich innych ustalonych linii komórkowych. Jeśli nie jesteś zaznajomiony z hodowlą iPSC, upewnij się, że uważnie przeczytałeś poniższe instrukcje.
Kluczowe punkty sukcesu
- Przeczytaj uważnie niniejszą instrukcję przed rozpoczęciem, w tym sekcje dotyczące wymaganych odczynników, rozmrażania, pasażowania, środków ostrożności i wskazówek dotyczących rozwiązywania problemów.
- Upewnij się, że wszystkie niezbędne odczynniki są dostępne przed rozmrożeniem komórek.
- Upewnij się, że sprzęt jest regularnie kalibrowany i nie upłynął termin ważności żadnych odczynników.
Metody
Certyfikat analizy (CofA) zawiera zalecenia dotyczące rozmrażania komórek w pożywkach i matrycach, które są specyficzne dla każdej linii komórkowej. W razie potrzeby używaną matrycę i pożywkę można zmienić na alternatywną tylko podczas pasażowania. Komórki mogą potrzebować czasu na adaptację po zmianie pożywki lub matrycy. Nie można udzielić żadnych gwarancji dotyczących żywotności lub jakości komórek w przypadku niestosowania zalecanego systemu hodowli tkankowej.
Przygotowanie macierzy zewnątrzkomórkowej
.Przygotowanie ekstraktu z błony podstawnej (BME)
Matryca żelowa ECM zakwalifikowana do komórek macierzystych (CC131) to rozpuszczalny ekstrakt błony podstawnej (BME) oczyszczony z guzów Engelbreth-Holm-Swarm (EHS), który został wstępnie zakwalifikowany do hodowli ludzkich komórek ES/iPS. Matryca polimeryzuje w temperaturze 20-40°C, tworząc odtworzoną błonę podstawną. Produkt zawiera między innymi lamininę, kolagen IV, entaktynę i siarczan heparanu. Matryca eliminuje potrzebę czasochłonnego wstępnego badania przesiewowego i identyfikacji partii, zapewnia zoptymalizowaną powłokę ECM niezbędną do długotrwałej hodowli pluripotencjalnych ludzkich komórek ES/iPS i wspiera hodowlę ludzkich komórek ES/iPS w wielu pożywkach do ekspansji ludzkich komórek ES/iPS bez surowicy/bez paszy (tj. mTeSR®, PluriSTEM™). Poniżej znajdują się ogólne wytyczne dotyczące powlekania płytek 6-dołkowych przy użyciu matrycy żelowej ECM Stem Cell Qualified. Wszystkie procedury powinny być wykonywane w warunkach aseptycznych w komorze bezpieczeństwa biologicznego.
- Odmrozić matrycę żelową ECM (CC131) w lodówce o temperaturze 2-8°C na jeden dzień przed użyciem. Po rozmrożeniu, utrzymuj ECM Gel na lodzie przez cały czas i używaj wstępnie schłodzonej pożywki i pipet, aby uniknąć żelowania produktu.
- Rozcieńczyć ECM Gel Matrix (CC131) 1:80 z zimną pożywką DMEM/F12 (D6421). Skaluj w górę lub w dół zgodnie z wymaganymi objętościami. Poniżej znajduje się przykład powlekania 6-dołkowej płytki 1,5 ml 1:80 rozcieńczonego żelu ECM.
Aby uzyskać rozcieńczenie 1:20, dodać 0,5 ml żelu ECM do 9,5 ml zimnego DMEM/F12 lub DMEM do probówki stożkowej o pojemności 15 ml. Całkowita objętość = 10 ml.
Do uzyskania końcowego rozcieńczenia 1:80 wymagane jest dalsze 4-krotne rozcieńczenie. Dodać 2,5 ml żelu ECM rozcieńczonego w stosunku 1:20 do 7,5 ml zimnego DMEM/F12.Całkowita objętość = 10 ml
UWAGA: Zalecane rozcieńczenie wynosi 1:80, jednak w razie potrzeby można użyć bardziej stężonego żelu ECM Stem Cell Qualified. - Dodaj 1,5 ml rozcieńczonego w stosunku 1:80 żelu ECM Matrix (CC131) do każdej studzienki 6-dołkowej płytki. Zawiruj płytki hodowlane, aby równomiernie rozprowadzić ECM Gel Matrix na powierzchni płytki. Przechowuj w lodówce w temperaturze 2 - 8°C przez noc lub co najmniej 2 godziny w lodówce przed użyciem. Jeśli nie zostaną użyte natychmiast, owinąć folią płytki hodowlane pokryte ECM i przechowywać w temperaturze 2-8°C, aż będą gotowe do użycia. Płytki hodowlane pokryte ECM należy zużyć w ciągu 3-4 dni.
- Przed posianiem komórek, należy przywrócić płytkę do temperatury pokojowej na 10-15 minut, usunąć roztwór powlekający i dodać 3 ml/basenik pożywki do wzrostu ludzkich ES/iPSC (SCM130). Komórki można teraz umieścić na nowo pokrytych płytkach.
WAŻNE: Nie dopuścić do wyschnięcia płytek.
Przygotowanie witronektyny
- Po otrzymaniu przechowywać witronektynę (CC130) w temperaturze -80°C. Przed użyciem rozmrozić fiolkę z Vitronektyną w temperaturze pokojowej i przygotować 60 μl podwielokrotności w sterylnych probówkach polipropylenowych. Zamrozić podwielokrotności w temperaturze -80°C lub użyć natychmiast. Jedna porcja 60 μL jest wystarczająca do pokrycia wszystkich dołków 6-dołkowej płytki.
- Aby przygotować witronektynę w stężeniu roboczym 0.5 μg/cm2, rozcieńczyć witronektynę w stosunku 1:100, delikatnie mieszając 6 ml PBS o temperaturze pokojowej (D8537) z 60 μl witronektyny. Dodaj 1 ml rozcieńczonej witronektyny do każdej studzienki 6-dołkowej płytki.
- Inkubuj pokryte naczynia hodowlane w temperaturze pokojowej przez 1 godzinę. Jeśli wymagane jest przechowywanie, naczynia mogą być uszczelnione folią Parafilm® (P7793) i przechowywane w temperaturze 2-8°C przez okres do 3 dni. Przed użyciem należy odczekać 1 godzinę, aż naczynie osiągnie temperaturę pokojową.
- Aby przygotować naczynie do hodowli, należy usunąć nadmiar witronektyny z naczynia hodowlanego i wyrzucić go. Nie jest konieczne mycie naczynia hodowlanego po usunięciu witronektyny.
Przygotowanie podłoża do hodowli komórkowej
mTeSR™-1
- W razie potrzeby wyjąć suplement mTeSR™1 (5x) z zamrażarki i rozmrozić przez noc w temperaturze 2-8 °C przed użyciem.Nie rozmrażać w temperaturze 37 °C.
- Aseptycznie dodać 100 ml suplementu mTeSR™1 (5x) do 400 ml zimnego (2-8 °C) podłoża podstawowego.
- Rozcieńczyć pożywkę do objętości wymaganej na 1 tydzień hodowli.
- Kompletny mTeSR™1 może być przechowywany w temperaturze 2-8 °C przez 1 tydzień lub w temperaturze -20 °C przez 6 miesięcy. Zamrożony kompletny mTeSR™1 można rozmrozić jeden raz. Nie należy wielokrotnie zamrażać i rozmrażać pożywki. Przed użyciem ogrzać mTeSR™1 do temperatury pokojowej. Nie pozostawiaj pożywki w temperaturze pokojowej na dłużej niż 2 godziny dziennie i unikaj ekspozycji na światło, aby uniknąć degradacji składników pożywki.
Essential 8™ (TeSR™-E8) Media
- W razie potrzeby wyjąć suplement E8 (50x) z zamrażarki i rozmrozić przez noc w temperaturze 2-8°C przed użyciem.Nie rozmrażać w temperaturze 37°C.
- Aseptycznie usuń 10 ml podłoża podstawowego E8, aby pozostawić 490 ml.
- Dodaj 10 ml suplementu E8 (50x) do 490 ml zimnego podłoża podstawowego (2-8°C).
- Rozcieńczyć pożywkę do objętości wymaganej na 1 tydzień hodowli.
- Kompletne E8 może być przechowywane w temperaturze 2-8 °C przez 1 tydzień lub w temperaturze -20 °C przez 6 miesięcy. Zamrożone kompletne E8 można rozmrozić jeden raz. Nie należy wielokrotnie zamrażać i rozmrażać pożywki. Przed użyciem ogrzać E8 do temperatury pokojowej. Nie pozostawiaj pożywki w temperaturze pokojowej na dłużej niż 2 godziny dziennie i unikaj ekspozycji na światło, aby uniknąć degradacji składników pożywki.
PluriSTEM® Human ES/iPSC Media<
PluriSTEM® medium (SCM130, SCM132) to kompletna pożywka bez surowicy oparta na małych cząsteczkach, która umożliwia hodowlę ludzkich komórek ES/iPS bez podajnika i pozwala na wymianę pożywki co drugi dzień bez uszczerbku dla morfologii lub długoterminowej funkcjonalności. Pożywka jest kompletna i nie wymaga dalszej suplementacji. W razie potrzeby należy wyjąć pożywkę z zamrażarki i rozmrozić przez noc w temperaturze 2-8°C przed użyciem. Nie rozmrażać w temperaturze 37°C. Po rozmrożeniu pożywkę PluriSTEM® należy przechowywać w temperaturze 2-8°C i zużyć w ciągu dwóch tygodni.
Thawing of Human iPSCs
- Komórki powinny zostać szybko rozmrożone poprzez umieszczenie kriofiolek w łaźni wodnej ustawionej na utrzymanie temperatury 37 °C. Delikatnie obracać fiolkę w łaźni wodnej, aby zapewnić szybkie rozmrożenie, ale nie zanurzać korka fiolki. Przed otwarciem zdezynfekuj fiolkę 70% etanolem (793213) lub równoważnym środkiem dezynfekującym.
- Używając sterylnej pipety o pojemności 5 ml, przenieś mieszaninę krioprotektantu i komórek z fiolki do probówki wirówkowej o pojemności 15 ml. Należy zachować ostrożność, aby nie uszkodzić fizycznie komórek.
- Powoli, kropla po kropli, dodaj 10 ml odpowiedniej pożywki w temperaturze pokojowej do komórek w 15 ml probówce wirówkowej. Delikatnie kołysz 15 ml probówką wirówkową tam i z powrotem podczas dodawania kropli pożywki. Jest to kluczowy krok, który minimalizuje szok osmotyczny komórek i pomaga zapewnić, że komórki są traktowane tak delikatnie, jak to możliwe.
- Sprawdź probówkę, aby upewnić się, że cała zawartość komórek została usunięta. W razie potrzeby przepłukać 1 ml odpowiedniej pożywki.
- Niewielka ilość komórek może być użyta do przeprowadzenia liczenia komórek. Pojedyncza zawiesina komórek powinna zostać utworzona przy użyciu trypsyny lub innej odpowiedniej pożywki oddzielającej komórki. Zgodnie z ogólnymi wytycznymi, zakres gęstości wysiewu dla jednego dołka płytki 6-dołkowej wynosi od 2x105 - 1x106 żywych komórek. Patrz CofA, aby uzyskać wytyczne dla określonego numeru partii linii komórkowej EBiSC.
- Wiruj komórki z prędkością 200 x g przez 2 minuty. Usunąć i odrzucić supernatant.
- Przygotować naczynia hodowlane, dodając odpowiednią ilość pożywki (na przykład 1,5 - 2 ml na jedną studzienkę płytki 6-dołkowej).
- Delikatnie stuknij w probówkę wirówkową o pojemności 15 ml, aby usunąć osad komórkowy, a następnie delikatnie dodaj 1 ml odpowiedniej pożywki i wysiej nasiona do 2 dołków powlekanej płytki 6-dołkowej (dostosuj, jeśli używasz innych formatów hodowli lub jeśli zalecono inaczej w certyfikacie analizy). Nie należy nadmiernie opryskiwać komórek, ponieważ doprowadzi to do zmniejszenia żywotności z powodu wytworzenia zawiesiny pojedynczych komórek.
- Delikatnie kołysz płytką na boki oraz w przód iw tył, aby równomiernie rozprowadzić komórki w dołku.
- Zaleca się rejestrowanie obrazów komórek bezpośrednio po rozmrożeniu, po 48 godzinach i przy około 70-80% konfluencji.
Culturing of Human iPSCs
- Dobrą praktyką jest codzienna obserwacja linii iPSC pod mikroskopem z kontrastem fazowym (powiększenie 4x, 10x, 20x i 40x) w celu sprawdzenia morfologii podobnej do iPSC, obecności zróżnicowanych komórek i konfluencji. Typowa punktacja została przedstawiona poniżej:
| Grade | Description |
|---|---|
| A | Optymalne, zagęszczone kolonie iPSC ze zdefiniowanymi krawędziami; morfologia jednolita w koloniach |
| B | Akceptowalne kolonie iPSC z pewnym zróżnicowaniem wokół krawędzi, komórki luźniej upakowane wewnątrz kolonii |
| C | Dobre przyleganie z pojawiającymi się małymi koloniami iPSCs |
| D | Słabe przyleganie i brak widocznych iPSCs |

Rysunek 1.Ocena kolonii iPSC

Rysunek 2.Poziomy różnicowania w kulturach iPSC
- Komórki są karmione poprzez usunięcie ~95% pożywki ze studzienek za pomocą pipety aspiracyjnej. Nie usuwaj całkowicie pożywki; cienka warstwa pożywki powinna pokrywać warstwę komórek, aby uniknąć ich wysuszenia.
- Aseptycznie dodaj 2 ml świeżej pożywki na 1 dołek 6-dołkowej płytki, delikatnie dodając ją z boku dołka. Inkubuj komórki w temperaturze 37°C / 5% CO2.
- Zwykle wymiana pożywki następuje codziennie przez sześć z siedmiu dni ze zwiększoną objętością pożywki (1,5x-2x normalna ilość; w zależności od gęstości komórek), jeśli komórki muszą być pozostawione na dłuższy czas między wymianą pożywki.
- Nie przekraczaj dwóch dni między wymianą pożywki.
Passaging ludzkich iPSC
EZ-LiFT™ Reagent Passaging Protocol
- Ogrzej EZ-LiFT™ Reagent (SCM139) do 37°C przed rozpoczęciem.
- Odpowietrz medium hodowlane i przemyj dołki dwukrotnie 1.5 ml odczynnika EZ-LiFT™ (SCM139).
- Dodaj 1 ml odczynnika EZ-LiFT™ (SCM139) do każdego dołka.Inkubować płytkę w temperaturze 37°C przez 4 minuty.
- Po 4 minutach szybko postukać w dno płytki (i.e. 20-25 stuknięć w ciągu 5 sekund).
- Umieść płytkę z powrotem w inkubatorze 37°C na dodatkowe 4 minuty.
- Po 4 minutach stuknij szybko w dno płytki (tj. 20-25 stuknięć w ciągu 5 sekund).
- Przeprowadź szybką inspekcję studzienek pod mikroskopem.
1. Jeśli widoczna jest znaczna liczba oderwanych grudek, przejdź do kroku 8.
2. Jeśli nie zaobserwowano wyraźnego oderwania, powtórz kroki 4-7, z tym wyjątkiem, że w kroku 5 inkubacja w temperaturze 37°C powinna trwać 2 zamiast 4 minut. Przejdź do kroku 8. - Delikatnie zbierz zawiesinę komórek (~ 1 ml) i przenieś do stożkowej probówki o pojemności 15 ml.Zneutralizować za pomocą 5 ml pożywki hodowlanej, delikatnie dodając pożywkę do zawiesiny komórek. Nie pipetować w górę i w dół, ponieważ może to spowodować rozbicie grudek komórek do zawiesiny jednokomórkowej.
- Wirować z prędkością 800 rpm przez 3 minuty. Odessać supernatant.
- Delikatnie ponownie zawiesić osad komórkowy w 1 ml pożywki wspierającej pluripotencję, takiej jak PluriSTEM® (SCM130).Nie należy pipetować w górę i w dół więcej niż dwa razy; nadmierne pipetowanie może spowodować dysocjację pojedynczych komórek;
- Przeprowadź zdysocjowane grudki komórek do nowo pokrytych 6-dołkowych płytek. Stosunek podziału powinien wynosić od 1:6 do 1:30. Codziennie monitoruj komórki. Komórki zazwyczaj osiągają 60-80% konfluencji w ciągu 6-8 dni, w zależności od stosunku podziału.
Protokół pasażowania akutazy
- Wystarczająca ilość PluriSTEM® (SCM130), Accutase (A6964) i DMEM/F12 (D6421) do pasażowania komórek. Ogrzej odczynniki w temperaturze pokojowej.
- Godzinę przed pasażowaniem komórek, dodaj inhibitor ROCK (ROCKi), Y-27632 (SCM075) do każdej studzienki 6-dołkowej płytki w końcowym stężeniu 10 μM.
- Po 1 godzinie, użyj mikroskopu dysekcyjnego, aby wizualnie sprawdzić płytkę zawierającą ludzkie komórki pluripotencjalne, które mają być pasażowane. Usunąć obszary spontanicznego różnicowania.
- Zasysać pożywkę zawierającą komórki z obszarów zeskrobanych ze studzienki. Przepłukać 2 ml na studzienkę pożywki DMEM/F-12 (D6421) lub 1X PBS (D8537).
- Zasysać i zastąpić 1 ml Accutase (A6964) na studzienkę płytki 6-dołkowej. Inkubować w temperaturze 37°C przez 8-10 minut.
- Skrócić reakcję Accutazy dodając 1 ml pożywki PluriSTEM® (SCM130) na każdy ml użytej Accutazy. Delikatnie oddzielić komórki za pomocą sterylnej końcówki pipety o pojemności 1000 μl.
- Zebrać zdysocjowane komórki do stożkowej probówki o pojemności 15 ml. Przepłucz dołki dodatkowymi 2 ml pożywki PluriSTEM® medium (SCM130), aby zebrać wszelkie pozostałe komórki. Dodaj popłuczyny do probówki stożkowej o pojemności 15 ml.
- Wiruj probówkę stożkową o pojemności 15 ml zawierającą zawiesinę komórek z prędkością 300 x g przez 5 minut w temperaturze pokojowej.
- Odwiruj supernatant. Ponownie zawiesić komórki w świeżej pożywce PluriSTEM® medium (SCM130) zawierającej 10 μM inhibitora ROCK, Y-27632 (SCM075).
- Zlicz liczbę komórek za pomocą licznika komórek Scepter™ lub hemocytometru. Upewnij się, że komórki są w zawiesinie jednokomórkowej. Określ żywotność komórek za pomocą wykluczenia błękitu trypanu (T8154).
- Ustaw miareczkowanie różnych gęstości komórek w zakresie od 0,5 -1x104 komórek/cm2. Odpowiada to 50 000 - 100 000 komórek na studzienkę 6-dołkowej płytki pokrytej Matrigelem w pożywce PluriSTEM® zawierającej 10 μM inhibitora ROCK.
- Następnego dnia zastąpić świeżą pożywką PluriSTEM® (SCM130). Wymieniać na świeżą pożywkę PluriSTEM® (SCM130) co 2 dni (objętość 3 ml na studzienkę). Komórki mogą być pasażowane co 5-7 dni.
Protokół pasażowania dyspazy
- Dostateczna ilość dyspazy II, 1 mg/ml (CC130) i DMEM/F12 (D6421) do pasażowania komórek. Ogrzej odczynniki w temperaturze pokojowej.
- Użyj mikroskopu dysekcyjnego do wizualnej kontroli płytki zawierającej ludzkie komórki pluripotencjalne, które mają być pasażowane. Sprawdź kolonie pod kątem obszarów spontanicznego różnicowania.
- Użyj sterylnej końcówki pipety p200 przymocowanej do pipetora p200, aby zeskrobać obszary spontanicznego różnicowania.
- Zasysaj pożywkę zawierającą komórki z zeskrobanych obszarów ze studzienki. Przepłukać 2 ml na studzienkę pożywki DMEM/F-12 (D6421) lub 1X PBS (D8537).
- Dodaj 1 ml dyspazy II, 1 mg/ml (CC130) na studzienkę 6-dołkowej płytki zawierającej pluripotencjalne ludzkie komórki ES lub iPS, które mają być pasażowane.
- Inkubuj w temperaturze 37°C przez 6-7 minut. Po inkubacji sprawdź wzrokowo kolonie pod mikroskopem. Krawędzie kolonii mogą wydawać się lekko zaokrąglone i/lub zagięte od powierzchni płytki, ale większość kolonii powinna być nadal przymocowana do płytki.
- Spryskaj Dispase II (CC130) i delikatnie przepłucz każdą studzienkę dwa razy 2 ml 1X PBS (D8537) lub DMEM/F12 (D6421).
- Dodaj 1,5-2 ml pożywki PluriSTEM® medium (SCM130) do każdej studzienki. Delikatnie odłącz kolonie za pomocą skrobaka do komórek.
- Użyj pipety serologicznej o pojemności 5 ml, aby zebrać agregaty komórek do stożkowej probówki o pojemności 15 ml. Zminimalizuj pipetowanie w górę i w dół, ponieważ może to spowodować rozbicie kolonii na nieoptymalne małe kawałki.
- Przepłucz studzienki dodatkowymi 2 ml pożywki PluriSTEM® medium (SCM130) na studzienkę, aby zebrać wszelkie pozostałe agregaty komórek. Dodać popłuczyny do probówki stożkowej o pojemności 15 ml.
- Wirować probówkę stożkową o pojemności 15 ml zawierającą agregaty komórek z prędkością 300 x g przez 5 minut w temperaturze pokojowej.
- Odwirować supernatant. Ponownie zawiesić agregaty komórek w odpowiedniej objętości pożywki PluriSTEM® (SCM130) do pasażowania. Podziel komórki w stosunku od 1:3 do 1:6, w zależności od liczby grudek komórek.
- Umieść płytkę w inkubatorze w temperaturze 37°C. Delikatnie poruszaj płytką z boku na bok oraz do przodu i do tyłu, aby upewnić się, że agregaty komórek są równomiernie rozmieszczone na powierzchni dołka.
- Następnego dnia zastąpić 3 ml na studzienkę świeżej pożywki PluriSTEM® medium (SCM130). Komórki mogą być pasażowane co 5-7 dni.
Kriokonserwacja ludzkich iPSC
- Przechowuj odczynniki i pojemnik do zamrażania (np.Mr. Frosty) podczas procedury kriokonserwacji.
- Kriokonserwacja komórek musi odbywać się w fazie logarytmicznego wzrostu, aby zwiększyć ich przeżywalność po rozmrożeniu. Optymalny czas zbioru jest zwykle wtedy, gdy komórki są w przybliżeniu 70-80% konfluentne
- Rodzaj stosowanej pożywki krioprotekcyjnej zależy od warunków hodowli i preferencji laboratoryjnych. Należy użyć dostępnego w sprzedaży Cryostor® CS10 (C2874) lub mieszaniny zamrażającej na bazie DMSO (D2650) (10% DMSO w FBS i pożywce hodowlanej).Pożywka Cryostor® jest dostarczana w postaci gotowej do użycia i przechowywana w temperaturze 2-8°C. Aby przygotować krioprotektant na bazie DMSO, wymieszaj 40% FBS z 10% DMSO, a następnie wymieszaj z 50% odpowiedniej pożywki.
- Usuń zużytą pożywkę z naczynia do hodowli tkankowej i przepłucz naczynie dwukrotnie zalecaną objętością buforu do płukania w zależności od warunków hodowli (bufor do płukania dla Cultrex/Matrigel to 0.5 mM EDTA; bufor płuczący dla witronektyny to PBS).
- Aby podnieść komórki z plastiku do hodowli tkankowej, dodaj 1 ml 0,5 mM EDTA (03690) do naczynia do hodowli tkankowej. Inkubuj komórki przez zalecany czas i temperaturę, w zależności od używanej matrycy. Odessać EDTA ze studzienki. Należy zachować ostrożność, ponieważ kolonie będą bardzo luźno związane z plastikiem.
- Dodaj 1 ml krioprotektantu na studzienkę. Delikatnie zmyj krioprotektant nad naczyniem za pomocą sterylnej pipety o pojemności 1 ml, aby usunąć komórki z plastiku. Nie aspirować więcej niż 3 razy, aby uniknąć dysocjacji skupisk komórek na pojedyncze komórki. Umieść krioprotektant i mieszaninę komórek w odpowiednio oznakowanej kriowialce.
- Jeśli pożądana jest kriokonserwacja większej liczby dołków, komórki z tego samego numeru pasażu i warunków hodowli powinny być połączone razem. Porcja połączonych komórek może być użyta do zliczenia komórek. Odwirować zebrane komórki przy 200xg przez 2 minuty, odessać zużytą pożywkę i delikatnie zawiesić osad komórkowy w odpowiedniej objętości krioprotektantu. Jedna studzienka 6-dołkowej płytki daje około 1-2 x 106 komórek. Zaleca się zamrożenie około 1-2 x 106 komórek na fiolkę. Użyj 1 ml mieszanki krioprotektant-komórki na fiolkę.
- Natychmiast umieść fiolki z komórkami w wstępnie schłodzonej (2-8°C) probówce Mr. Frosty, a następnie natychmiast przenieś probówkę Mr. Frosty do zamrażarki o temperaturze -80°C. Pozostawić komórki w temperaturze -80°C na noc (16-36 godzin). Po zamrożeniu, przenieś komórki na suchym lodzie do naczynia do przechowywania w bardzo niskiej temperaturze (ciekły introgen lub zamrażarka -150°C).
Charakterystyka ludzkich iPSCs
.Niezróżnicowany stan iPSCs charakteryzuje się wysokim poziomem ekspresji fosfatazy alkalicznej (SCR004) i czynników transkrypcyjnych komórek macierzystych Nanog, Oct-4 i Sox-2. Komórki te wykazują również wyraźne różnice w stosunku do swoich mysich odpowiedników pod względem ekspresji antygenu embrionalnego specyficznego dla danego etapu (SSEA1, 3, 4) i markerów podokaliksyny (TRA-1-60, TRA-1-81). Komórki można analizować za pomocą barwienia przeciwciałami ICC przy użyciu zestawów do charakteryzacji komórek macierzystych (SCR001, SCR002, SCR078) lub poprzez analizę PCR.
| Typ komórki | Fosfataza alkaliczna | Oct-4 | Sox-2 | Nanog | SSEA-1 | SSEA-4 | TRA-1-60 | TRA-1-81 |
|---|---|---|---|---|---|---|---|---|
| Ludzkie iPSC | + | + | + | + | - | + | + | + |
| Mouse iPSC | + | + | + | + | + | - | - | - |
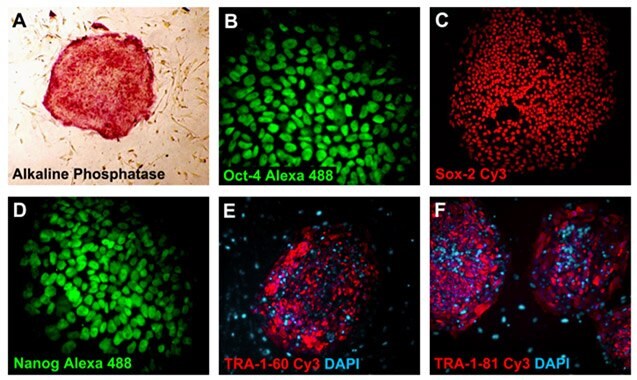
Rysunek 3. Pluripotencjalne komórki iPS wykazują ekspresję markerów pluripotencji. Fosfataza alkaliczna (40x) (A), Oct-4 Alexa 488 (MAB4401A4, 400x) (B), Sox-2 Cy3 (MAB4423C3, 100x) (C), Nanog Alexa 488 (MABD24A4, 400x) (D), TRA-1-60 Cy3 (MAB4360C3, 100x) (E) i TRA-1-81-Cy3 (MAB4381C3, 100x) (F). Jądra zostały wybarwione DAPI (niebieski) (D9542).
| Problem | Obserwacja | Rozwiązanie |
|---|---|---|
| Niska żywotność iPSCs po rozmrożeniu | - Niewiele lub brak widocznych kolonii w ciągu 4 dni po odzyskaniu | - Upewnić się, że kriofiole są szybko rozmrażane, a pożywka jest dodawana do komórek bardzo powoli (kroplami, delikatnie mieszając probówką) - Dodać 10 μm inhibitora ROCK podczas rozmrażania, ale nie stosować go rutynowo - Upewnić się, że komórki są dobrze rozmrożone.br /> - Upewnij się, że komórki zostały zbankowane w fazie logarytmicznego wzrostu z niskim poziomem różnicowania - Pozwól małym koloniom rosnąć aż do uzyskania solidnego wzrostu i pasażuj z niskim stosunkiem podziału (1:1 lub 1: |
| Niska żywotność po pasażowaniu | - Komórki nie przyłączają się prawidłowo | - Użyj niższego współczynnika podziału i utrzymuj bardziej konfluentną hodowlę - Upewnij się, że komórki są w fazie logarytmicznego wzrostu podczas pasażowania - Pracuj szybko lub skróć czas inkubacji EDTA, ponieważ zbyt długa ekspozycja na EDTA może mieć wpływ na rozmiar grudek - Wydłuż czas inkubacji EDTA, jeśli komórki nie odrywają się łatwo. Ma to na celu uniknięcie zbyt turbulentnego płukania komórek, a tym samym tworzenia zbyt małych agregatów lub zawiesiny pojedynczych komórek - Sprawdź, czy płytki zostały prawidłowo pokryte, czy matryca jest w okresie ważności i sprawdź partię u producenta, jeśli problem ten występuje regularnie, a inne przyczyny zostały wykluczone |
| Spontaniczne różnicowanie | - Kolonie nie mają zdefiniowanych krawędzi | - Upewnij się, że komórki są hodowane zgodnie z zaleceniami (tj.Codzienne karmienie komórek) - Upewnij się, że odczynniki są świeżo przygotowane (tj. zużyte w ciągu dwóch tygodni) - Unikaj pozostawiania płytek poza inkubatorem, aby zminimalizować wahania temperatury i ekspozycję na światło. - Zmniejszenie gęstości kolonii poprzez umieszczenie mniejszej liczby agregatów komórek na cm2 podczas pasażowania - Jeśli dobre kolonie iPSC utrzymują się pomiędzy zróżnicowanymi obszarami, można rozważyć ręczne wybranie kolonii o dobrej morfologii iPSC za pomocą końcówki pipety. Zaleca się wybranie kilku kolonii i podzielenie ich za pomocą końcówki pipety, podniesienie ich, odessanie, a następnie przeniesienie do świeżej studzienki 1:6. - Można rozważyć usunięcie zróżnicowanych komórek poprzez zeskrobanie zróżnicowanych obszarów za pomocą końcówki pipety, pozostawiając nienaruszone kolonie iPSC. Należy zachować ostrożność, aby nie naruszyć kolonii iPSC i nie zeskrobać zbyt dużej ilości warstwy macierzy w tym procesie. |
| Nierównomierny rozkład kolonii w obrębie płytki | - Obszary, w których gęstość komórek iPS jest zbyt wysoka. Znaczne obszary powierzchni płytki mają niewiele kolonii lub nie mają ich wcale. | - Upewnij się, że cała powierzchnia naczynia do hodowli tkankowej jest równomiernie pokryta odpowiednią matrycą - Upewnij się, że agregaty komórek są równomiernie rozłożone poprzez delikatne kołysanie płytką do przodu i do tyłu. delikatnie kołysząc płytką w przód i w tył oraz na boki - Zachowaj ostrożność podczas umieszczania płytki w inkubatorze i pozostaw niezakłóconą przez 24 godziny |
| Niezbędne jest znaczne zeskrobanie.br />wymagane do usunięcia komórek | - Kolonie nie uwalniają się z płytki po 2-3 płukaniach pipetą 1 ml | - Upewnić się, że czas inkubacji i temperatura EDTA są zgodne z matrycą - Wydłużyć czas inkubacji EDTA - Nie dopuścić do konfluencji komórek większej niż 70% - Nie dopuścić do zarośnięcia wnętrza kolonii. Czasami konieczne jest przejście przez mniej konfluentną płytkę z mniejszą liczbą, ale solidnych kolonii, przy użyciu niższego współczynnika podziału |
| Słabe przywiązanie i znaczny wzrost śmierci komórek po pasażowaniu | - Komórki zaczynają odrywać się od płytki, nawet jeśli wydawało się, że przyłączyły się natychmiast po pasażowaniu | - Zamiast wymieniać pożywkę, uzupełnij studzienki świeżą pożywką, aby zapewnić wystarczające stężenie składników odżywczych i pozostaw komórki niezakłócone przez dodatkowe 24 godziny, aby umożliwić agregatom pełne przyłączenie - Wymieniaj pożywkę bardzo delikatnie. Nie należy narażać kolonii na nadmierne siły ścinające poprzez szybkie dodanie pożywki |
Powiązane produkty
Response not successful: Received status code 500
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?Dla wygody naszych klientów ta strona została przetłumaczona maszynowo. Dołożyliśmy starań, aby zapewnić dokładne tłumaczenie maszynowe. Tłumaczenie maszynowe nie jest jednak doskonałe. Jeśli tłumaczenie maszynowe nie spełnia Twoich oczekiwań, przejdź do wersji w języku angielskim.