Wir sind alle in
als Ihr engagierter CDMO- und Testpartner, bei jedem Schritt des Weges.
CDMO und Prüfdienste
True Partnership Every Step of the Way
Um Therapien zum Leben zu erwecken, braucht es mehr als Wissenschaft - es braucht Herz. Es braucht einen Verbündeten, der sich voll für Ihren Erfolg einsetzt. Als Ihr engagierter CDMO- und Testpartner stehen wir Ihnen bei jedem Schritt Ihrer Arzneimittelentwicklung zur Seite.
Mit unserer jahrzehntelangen Erfahrung in den Bereichen Auftragsentwicklung, Herstellung und Biosicherheitstests kombinieren wir operative Exzellenz mit persönlichem Engagement, um Ihnen zu helfen, Ihre Meilensteine zu beschleunigen, Risiken zu minimieren und Ihre Therapien für Patienten weltweit bereitzustellen. Wir orientieren uns an Ihren Zielen und engagieren uns für Ihren Erfolg.
Was auch immer Ihre Innovation, was auch immer Ihre Herausforderung ist, wir wissen, dass jede Entdeckung, jeder Durchbruch und jedes verbesserte Leben ein gemeinsames Engagement für den Erfolg erfordert. Gemeinsam sind wir alle dabei, um Fortschritt und Innovation zu beschleunigen.
Gemeinsam sind wir alle dabei
Erleben Sie den Unterschied durch unser integriertes Fachwissen:
- Wurzelnd in mehr als 35 Jahren CDMO-Zuverlässigkeit.
- Gestützt durch mehr als 75 Jahre Erfahrung mit Biosicherheitstests.
- Partnerschaftlich unterstützt von einem globalen Team von der Präklinik bis zur Vermarktung.
- Persönlich engagiert für Ihre therapeutischen Ziele.
- Nachgewiesene Expertise in den Bereichen Small Molecule APIs & HPAPIs, ADC & Bioconjugation, mRNA & LNP, virale Vektoren und Mammalian Biologics (Testdienstleistungen).
- Wir sind stolz auf unseren guten Ruf in Bezug auf die Einhaltung von Vorschriften und Qualität
"Wir setzen uns für unsere Kunden und ihre Patienten ein. Das bedeutet, dass wir alle im Gleichschritt mit unseren Kunden über alle Funktionen hinweg zusammenarbeiten, um den Patienten bessere und schnellere Behandlungen auf die sicherste und wirksamste Weise zukommen zu lassen."
Benjamin Hein,
Head of Life Science Services
Der Wert, den wir bieten
Wir sind bekannt für unser umfassendes Fachwissen und unser breites Portfolio - mit standardsetzenden Innovationen und der Entwicklung von Vorlagen, die die Branche voranbringen.
Flexibilität durch Fertigungs- und Prüfkapazitäten - erhebliche Investitionen in unsere Fähigkeiten und Kapazitäten, um mit den komplexen Anforderungen der Industrie an die Lieferkette Schritt zu halten.
Wir verfügen über jahrzehntelange Erfahrung, um unsere Kunden zu informieren und auf ihrem Weg zur Zulassung zu begleiten. Unser globales regulatorisches Know-how gewährleistet hohe Qualitätsstandards und die Einhaltung von Vorschriften.
Fokussierte Führung über alle Modalitäten hinweg

ADC & Biokonjugation
Antikörper-Wirkstoff-Konjugate (ADC) erfordern eine Kombination aus präzisem Design und spezialisiertem Fachwissen - und das alles in kürzester Zeit. Mit mehr als 15 Jahren Erfahrung in der Auftragsentwicklung und -herstellung sind wir für unsere führende Expertise in der Konjugation von Wirkstoff-Linkern an monoklonale Antikörper (mAbs) bekannt und verfügen über Anlagen, die auf die Handhabung hochwirksamer Verbindungen spezialisiert sind.

mRNA-Herstellung & LNP-Formulierung
Die mRNA-Landschaft verändert sich rasant, und die Kunden benötigen die neueste Technologie und neue therapeutische Ansätze, um Moleküle zum Leben zu erwecken. Mit der umfassendsten mRNA-Wertschöpfungskette auf dem Markt und integrierten Dienstleistungen unterstützen wir unsere Kunden erfolgreich von der mRNA über Lipide bis zur LNP-Formulierung.

Kleine Moleküle
Klein im Namen, groß in der Wirkung für den Patienten. Wir bieten einen echten beratenden Partneransatz für ein breites Spektrum an kleinen Molekülmodalitäten. Von APIs zu HPAPIs, PEGs zu ADC-Linker-Payloads, gezieltem Proteinabbau bis hin zu neuartigen Formatkonjugaten - unsere jahrzehntelange Erfahrung reduziert die Komplexität und minimiert das Risiko im Rennen um die Kommerzialisierung.

Virale Vektoren
Unsere Erfahrung mit Adeno-assoziierten Viren, Lentiviren, Adenoviren und anderen Vektoren rationalisiert die Entwicklung und Herstellung von Gen- oder Zelltherapien. Vertrauen Sie auf einen Partner, der seit mehr als 25 Jahren unermüdlich Innovationen bei der Vermarktung viraler Vektoren vorantreibt und mit den neuesten Technologien und Prozessen in kürzester Zeit Maßstäbe setzt. Ganz gleich, ob sich unsere Kunden in der präklinischen Phase befinden oder kurz vor der Kommerzialisierung stehen, wir verfügen über die Ressourcen, Fähigkeiten und das Wissen, um aktuelle und zukünftige Therapien voranzutreiben.
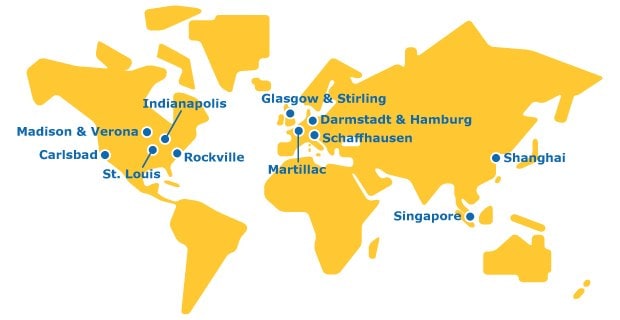
Die globale Präsenz
Wir sind ein einziges Unternehmen mit einem globalen Netzwerk, das Auftragsentwicklungs-, Herstellungs- und Prüfdienstleistungen in allen Phasen der Wertschöpfungskette von Molekülen anbietet.
Europa

Kommerzialisierung für die Wirkstoffproduktion im großen Maßstab und Portfolio-Lipide. Kontinuierliche Investitionen in den Ausbau unseres globalen Netzwerks von API-Produktionsanlagen bieten sofortige Entwicklungs- und Produktionskapazitäten.

Unser Standort für Biosicherheitstests beherbergt unsere Dienstleistungen für die Herstellung von Zellbanken, Biorepositorien, die Charakterisierung von Zelllinien und die Prüfung der Freisetzung von Wirkstoffen und Arzneimitteln.

Unser mRNA-Herstellungsstandort für unsere integrierten CDMO-Fähigkeiten umfasst die Entwicklung und Herstellung von kundenspezifischen mRNAs.

Entwicklung, Herstellung und Markteinführung von Wirkstoffen, funktionalisierten Polyethylenglykolen (PEGs) und Lipiden.

Unser Standort verfügt über Studiensuiten für die Virusfreigabe. Unser Provise™ Clearance Service setzt ein Team hochqualifizierter & erfahrener Prozesswissenschaftler und Studienleiter in Ihrem Namen ein, um alle erforderlichen Prozessschritte in unserer hochmodernen Anlage in Stirling durchzuführen.
Asien

Die Servicestelle für Biosicherheitstests führt für unser integriertes CTDMO die Charakterisierung von Zelllinien, die Freigabe von Viren und die Prüfung der Freisetzung von Wirkstoffen und Arzneimitteln durch.
Um weiterzulesen, melden Sie sich bitte an oder erstellen ein Konto.
Sie haben kein Konto?Um unseren Kunden ein besseres Nutzungserlebnis zu bieten, wurde diese Seite maschinell übersetzt. Unser Ziel ist es, eine möglichst originalgetreue maschinelle Übersetzung zur Verfügung zu stellen. Eine solche Übersetzung ist jedoch nicht perfekt. Wenn Sie mit dem maschinell übersetzten Inhalt nicht zufrieden sind, wechseln Sie bitte zur englischen Webseite.





